【CMT&CHTV 文献精粹】
导语:本文深入探讨了葡萄糖转运蛋白GLUT1和GLUT2在人类β细胞中的作用及其在血糖调控中的重要性,不仅填补了现有科学知识中的空白,还为糖尿病的潜在治疗提供了新的视角和策略。
维持葡萄糖稳态是预防和治疗糖尿病的核心策略,而葡萄糖转运蛋白(GLUT)在调控血糖中的作用至关重要。近年来,随着分子生物学和代谢研究的进展,GLUT在不同组织中的特异性表达和功能调控受到了广泛关注。然而,尽管小鼠模型在代谢研究中被广泛使用,人类与小鼠在血糖调控机制上的显著差异限制了这些研究结果向临床应用的转化。小鼠和人类在胰岛细胞的GLUT表达谱、胰岛素分泌反应以及葡萄糖代谢途径上存在显著差异,这使得基于小鼠模型的研究结果在临床上的适用性受到质疑。
2024年8月,美国糖尿病协会官方期刊Diabetes发表了一篇题为“Glucose Transporters Are Key Components of the Human Glucostat”的研究,通过采用先进的单细胞RNA测序技术和高分辨率成像技术,深入探讨了人类β细胞中GLUT1和GLUT2在葡萄糖稳态中的关键作用,揭示了这两种蛋白的表达模式及其在葡萄糖感知和胰岛素分泌中的功能差异,为糖尿病的精准治疗提供了新的靶点。
研究方法
本研究是一项综合性的实验研究,旨在阐明GLUT1和GLUT2在人类β细胞功能中的作用,并建立物种特异性血糖设定点。研究纳入了成人和胎儿的胰岛细胞,以及从小鼠模型中得到的胰岛,通过化学抑制和基因编辑技术,评估了GLUT1和GLUT2在葡萄糖摄取和胰岛素分泌中的功能需求。研究的主要终点是葡萄糖摄取率和胰岛素分泌水平,次要终点包括GLUT1/2在不同细胞群体中的表达模式。
研究结果
β细胞中GLUT1与GLUT2表达的特异性
研究发现,GLUT1和GLUT2在成人和胎儿β细胞中的表达存在明显差异。结果显示,在成人β细胞中,GLUT1作为主导的葡萄糖转运蛋白,其表达比例高达77.6%,而仅有13.2%的β细胞同时表达GLUT1和GLUT2。相对于成人,胎儿β细胞中GLUT2的表达比例显著增加,约33.8%的胎儿β细胞同时表达这两种转运蛋白,而仅有4.2%的胎儿β细胞仅表达GLUT2(图1)。这一发现表明,β细胞在不同发育阶段的葡萄糖感应和胰岛素分泌机制可能存在显著差异,这些差异在调节血糖水平和应对代谢需求变化中起着关键作用。
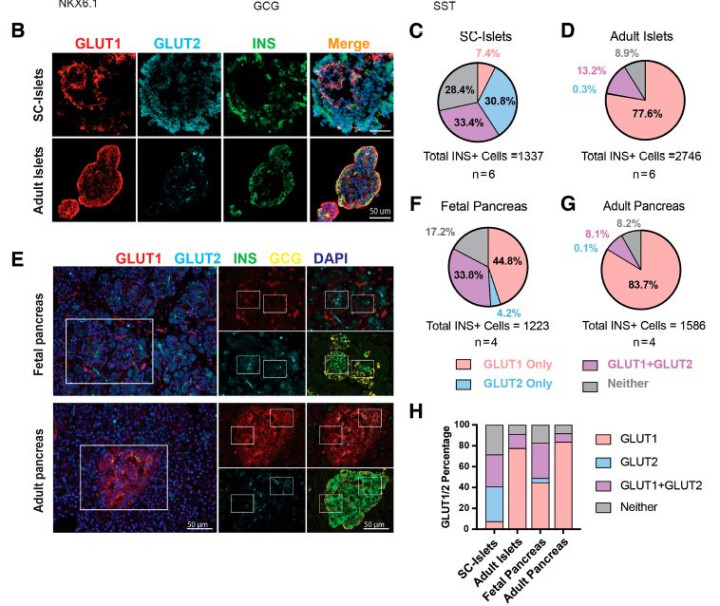
注:B. 胎儿和成人胰岛细胞免疫染色结果;C、D. 胎儿(C)和成年人(D)β细胞中GLUT1和GLUT2的表达水平;E. 胎儿(上)和成人(下)胰腺切片免疫染色结果;F、G. GLUT1和GLUT2在胎儿(F)和成人(G)胰岛中的表达水平;H. GLUT1和GLUT2在β细胞不同亚群中的分布。图1 GLUT1和GLUT2在胎儿和成年人群中的表达水平
人类胰岛移植对小鼠血糖设定点的影响
通过将人类干细胞衍生胰岛(SC-islets)细胞移植到小鼠模型中,研究人员观察到小鼠的血糖水平被成功调节至人类血糖范围。其中,移植后的小鼠在1个月开始展现出与对照组相比显著降低的血糖水平,这一差异在2个月后进一步扩大,并持续至实验结束的91天(图2)。此发现不仅证实了β细胞在血糖设定中的核心作用,也揭示了人类与小鼠在血糖调控机制上存在本质的差异(图3)。
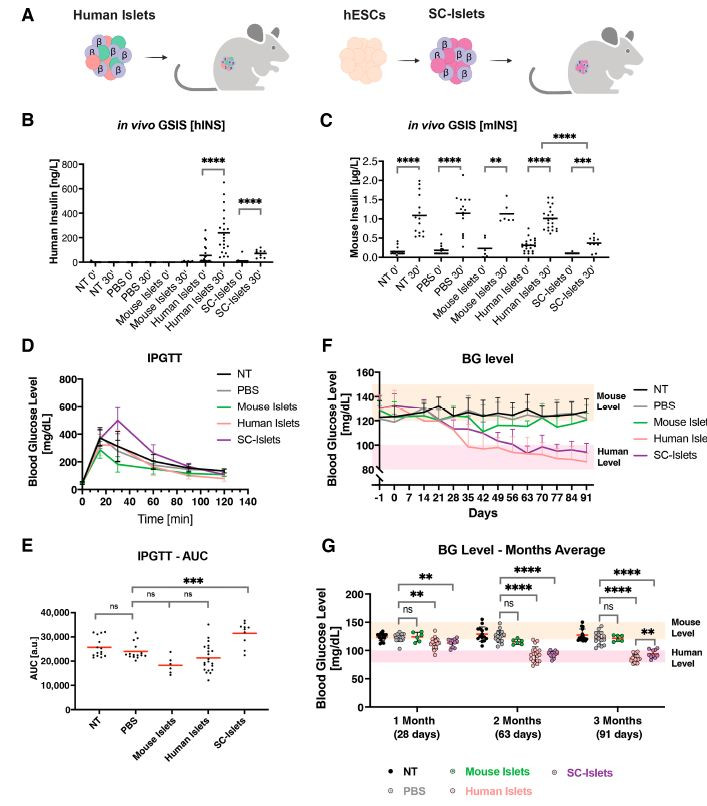
注:A. 研究设计;B. 移植前后小鼠血液中的人类胰岛素水平;C. 移植前后小鼠血液中的鼠类胰岛素水平;D. 注射葡萄糖后不同时间点的血糖水平测量结果;E. 不同组别血糖曲线下面积(AUC)的总结;F. 移植后小鼠非空腹血糖水平的监测结果;G. 移植后1、2、3个月的小鼠非空腹血糖水平。图2 人β细胞移植可降低小鼠BG水平
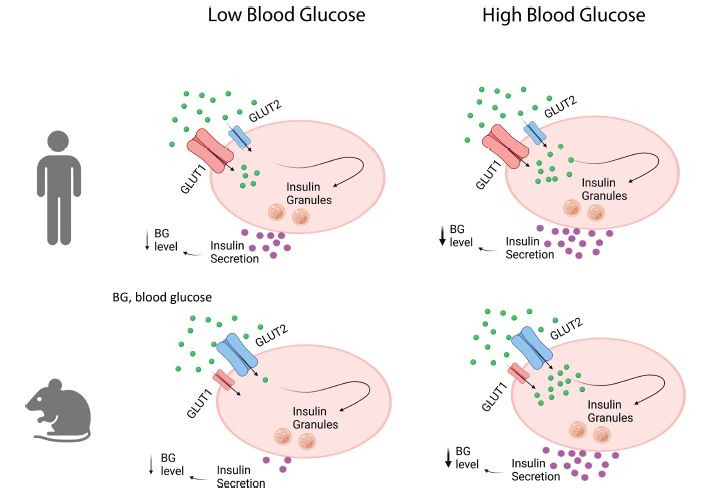
图3 人类与小鼠血糖调控机制的差异
葡萄糖转运蛋白在葡萄糖摄取和胰岛素分泌中的作用
通过化学抑制GLUT1和遗传破坏GLUT2的实验,研究明确了这两种转运蛋白在葡萄糖摄取和胰岛素分泌中的关键功能。特别是在成人胰岛中,GLUT1的抑制导致在5 mmol/L和17 mmol/L的2DG处理条件下葡萄糖摄取显著减少,显示出GLUT1在葡萄糖摄取中的必要性。此外,动态葡萄糖刺激胰岛素分泌(dGSIS)实验中,GLUT1的抑制在两种葡萄糖浓度下均导致胰岛素分泌显著降低,进一步证实了GLUT1在胰岛素分泌中的关键作用。
数学模型对葡萄糖转运蛋白功能的预测
研究团队开发了一个数学模型,用以预测GLUT1/2表达变化对葡萄糖摄取和胰岛素分泌的影响。模型通过综合考虑GLUT1和GLUT2的表达比例、细胞内外葡萄糖浓度以及葡萄糖转运和磷酸化速率,成功预测了不同GLUT表达状态下的细胞内葡萄糖水平。模型预测结果与实验数据高度吻合,为理解GLUT1和GLUT2在β细胞功能中的作用提供了新的理论支持。
总结
本研究综合运用了多种实验技术和数学建模方法,全面评估了GLUT1和GLUT2在人类β细胞功能中的作用(图3)。研究结果不仅加深了我们对葡萄糖稳态调节机制的理解,也为糖尿病的临床治疗提供了新的策略。特别是在人类与小鼠模型之间的差异性研究中,本文提供了重要的见解,有助于未来研究更精确地模拟和治疗人类疾病。
参考文献
CASPI I, TREMMEL D M, PULECIO J, et al. Glucose Transporters Are Key Components of the Human Glucostat[J]. Diabetes, 2024, 73(8): 1336-1351. DOI: 10.2337/db23-0508.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
